


3月17日,日內瓦藥品專利池(Medicines PatentPool, MPP)組織宣布,已與35家藥企簽署協議,授權其生產輝瑞口服新冠治療藥物奈瑪特韋(nirmatrelvir)仿制藥,并向覆蓋全球約53%人口的95個中低收入國家供應奈瑪特韋/利托那韋組合包裝產品(Paxlovid),以提高新冠治療藥物在全球中低收入國家或地區的可及性和可負擔性。
根據MPP官方新聞稿,本次非獨家分許可(The non-exclusive sublicences)允許獲授權的企業生產輝瑞新冠口服藥奈瑪特韋原料藥及其成品藥與利托那韋組合包裝。MPP同時在其新聞稿中表示,本次獲許可的企業證明了他們有能力滿足MPP對生產能力、監管合規以及生產質量符合國際質量標準的藥品的要求。在本次與MPP簽署協議的35家企業中共有5家中國企業,分別是上海迪賽諾、華海藥業、普洛藥業、復星醫藥、九洲藥業。其中,九洲藥業僅獲授權生產原料藥,另外包括復星醫藥在內的4家可同時生產原料藥和制劑。
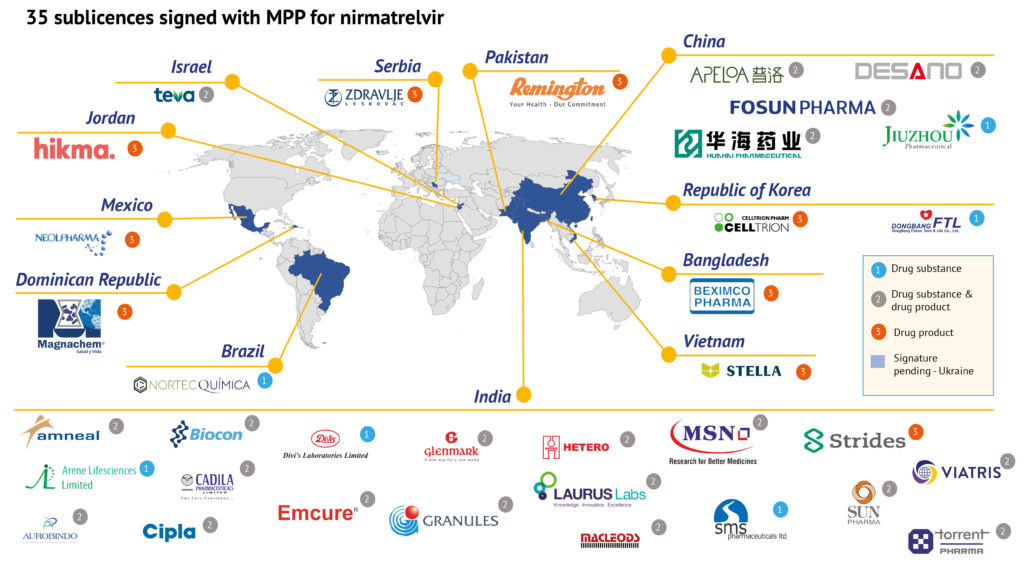
據悉,35家公司中,6家將重點生產原料藥,9家將負責生產制劑,其余20家企業同時生產原料藥和制劑。它們遍布12個國家:孟加拉國、巴西、中國、約旦、印度、以色列、墨西哥、巴基斯坦、韓國、越南、塞爾維亞、多米尼加共和國。此前,MPP組織表示,第一批paxlovid藥物將在今年12月前供應。
奈瑪特韋/利托那韋組合包裝是一款組合包裝的口服新冠治療藥物,用于治療成人伴有進展為重癥高風險因素的輕至中度新型冠狀病毒肺炎(COVID-19)患者。奈瑪特韋(制劑)(Nirmatrelvir,即PF-07321332)是一種新冠病毒主蛋白酶(MPRO,也被稱為3CL蛋白酶)抑制劑,利托那韋(Ritonavir)是一種HIV-1蛋白酶抑制劑和CYP3A抑制劑。與低劑量的利托那韋組合給藥,有助于減緩奈瑪特韋的代謝或分解,使其在較高濃度下在體內保持較長時間的活性,以幫助對抗新冠病毒。
輝瑞公司的奈瑪特韋片/利托那韋片組合包裝產品(PAXLOVIDTM)于2021年12月獲得美國食品藥品監督管理局的緊急使用授權,2022年1月獲得歐洲藥品管理局有條件批準,2022年2月獲得日本厚生勞動省特例批準,并于2022年2月獲得中國國家藥品監督管理局的應急附條件批準。目前,該藥物已在全球超過50個國家獲得批準上市。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn