



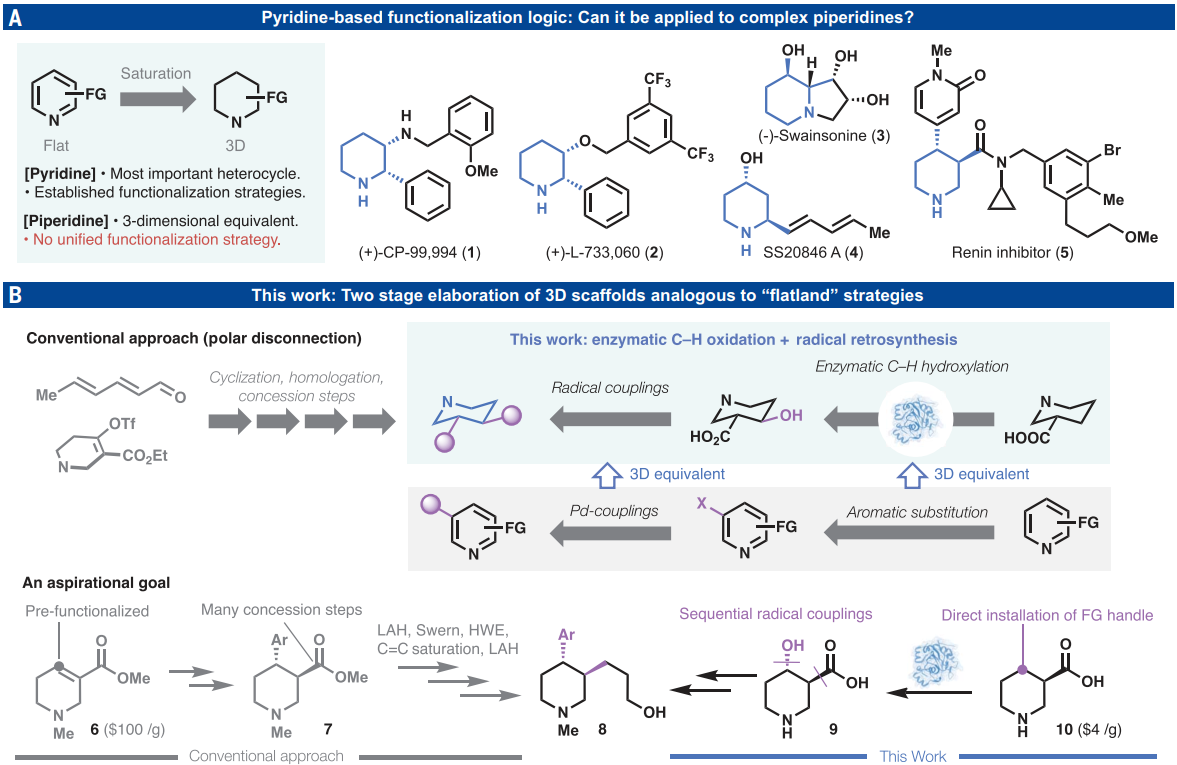
正文
吡啶及其苯并環(huán)類似物可能是最重要的雜芳族單元,因為它們廣泛存在于FDA批準的藥物中(圖1A)。隨著藥物發(fā)現活動逐漸轉向拓撲更復雜的3D空間(增加Fsp3),哌啶正變得越來越受歡迎,如化合物1-5,其中二取代哌啶占目前含哌啶藥物的61%。與制備不飽和吡啶類似物不同,此類骨架的模塊化合成和精確的立體化學控制極具挑戰(zhàn),嚴重依賴于羰基和烯烴化學(圖1B)。定向進化技術促進的酶促C-H氧化現在是可擴展且位點特異性地將功能團安裝到未活化的Csp3-H鍵上的最有效方法之一。自由基交叉偶聯作為一種多功能平臺,用于偶聯常見的含Csp3的功能團,如酸和醇,類似于使用Suzuki和相關偶聯對吡啶進行偶聯。圖1B所示的二取代哌啶8的理想合成說明了結合這兩種策略的潛在威力。原則上,直接獲取哌啶如8可以通過兩個簡單的階段來實現:廉價10 的生物催化C-H氧化,然后對所得的酸和醇功能團進行兩次連續(xù)的自由基交叉偶聯。本文中,作者提出了這一可推廣邏輯的概念證明,即通過可擴展的生物催化途徑獲得大量羥基化哌啶,然后進行模塊化自由基交叉偶聯。 歡迎下載化學加APP到手機桌面,合成化學產業(yè)資源聚合服務平臺。
本研究的第一階段需要可擴展的酶促方法,對對映體純的2-和3-羧基化哌啶11 和10進行位點特異性C-H羥基化。反式-4-脯氨酸羥化酶(trans-P4H)是一種2-酮戊二酸(α-KG)依賴性雙加氧酶,對L-脯氨酸具有 C4羥基化活性,在對反應參數進行大量優(yōu)化后,最終將轉化率提高到99%以上。優(yōu)化條件適用于克級合成,底物濃度高于之前報道的條件(15對 1 mM)。考慮到羥基化結構單元的立體化學模式會對后續(xù)功能化的立體化學結果產生重大影響,因此尋求合成順式-5-羥基-L-Pip 13。為此,作者研究了Xenorhabdus doucetiae(XdPH YR)的工程化α-KG依賴性L-哌可酸羥化酶和Codexis開發(fā)的脯氨酸-4-羥化酶(P4H810)。前者幾乎不將L-哌可酸(L-Pip)轉化為所需產物,而后者以區(qū)域和立體選擇性的方式生成5-羥基化L-Pip 13,轉化率為80%。隨后對反應pH進行了優(yōu)化,將轉化率提高到~100%。所有酶促羥基化反應均以高度非對映選擇性的方式進行,生成產物12、13和9,非對映體比(dr) >99:1。
(圖片來源:Science)
迄今為止,尚無催化3-羧化哌啶(尼泊西酸,nipecotic acid)羥基化的酶實例。為了填補這一空白,作者篩選了一組用于尼泊西酸反應的酶。初步嘗試產生了轉化率為90%的反式-4-羥基-D-Nip,其結構通過相關NMR分析和二硝基苯甲酰胺衍生物的X-射線晶體學得到確認。將α-KG的當量從2.5增加到5.0,轉化率提高到~100%,這也適用于更高的底物濃度(15 mM)。初步對接研究表明,D-Nip在活性位點表現出與ectoine不同的結合模式,具體依賴于羧酸基序與Gln127、Arg129和Arg280之間的極性相互作用。利用上述構建塊,常規(guī)Boc保護完成了五個關鍵哌啶(14-18)的合成,這構成了后續(xù)合成探索的基礎。
由于掌握了關鍵羥基化哌啶的強大生物催化途徑,因此使用自由基交叉偶聯方法探索了其下游模塊化功能化。選擇了一組2-取代-3羥基哌啶(圖3A),之前所采用的主要合成策略是使用手性池策略中間體或手性助劑,通過極性鍵斷開然后閉環(huán)來實現1,2-氨基醇片段的非對映選擇性合成。在報道的10條路線中,大多數路線都缺乏非對映選擇性、路線冗長(7到17步)、低溫溫度和昂貴的過渡金屬。相比之下,羥基哌啶14可以簡單地與碘苯進行化學選擇性Ni-電催化脫羧交叉偶聯,直接得到19(48%的分離產率,單一非對映體)。同樣的辦法也可用于獲取苦馬豆素(swainsonine)3,已報道了40多種苦馬豆素合成方法,合成步驟從6步到>20步不等(平均約14步)。這些合成中最短的從5-氯戊醛開始,涉及不對稱氯化,需要在低溫(-35 °C)下反應19天才能得到82%對映體過量的醛24。隨后進行炔基鋰加成和林德拉還原,得到Z-烯烴 25。脫除Boc基團后,必須嚴格控制當量和NaOH加入烯基氯醇的速率,以避免形成不需要的四氫呋喃副產物;22的二羥基化得到天然產物3。相比之下,本文的方法有五步,使用相同的羥基哌啶14通過高壓電催化脫羧烯基化與碘化乙烯20進行反應來制備21。隨后的一鍋法Appel反應和環(huán)化得到相同的中間體 22,其可在二羥基化后轉化為3,從而避免了實驗上耗時的步驟、低溫和Pd催化。
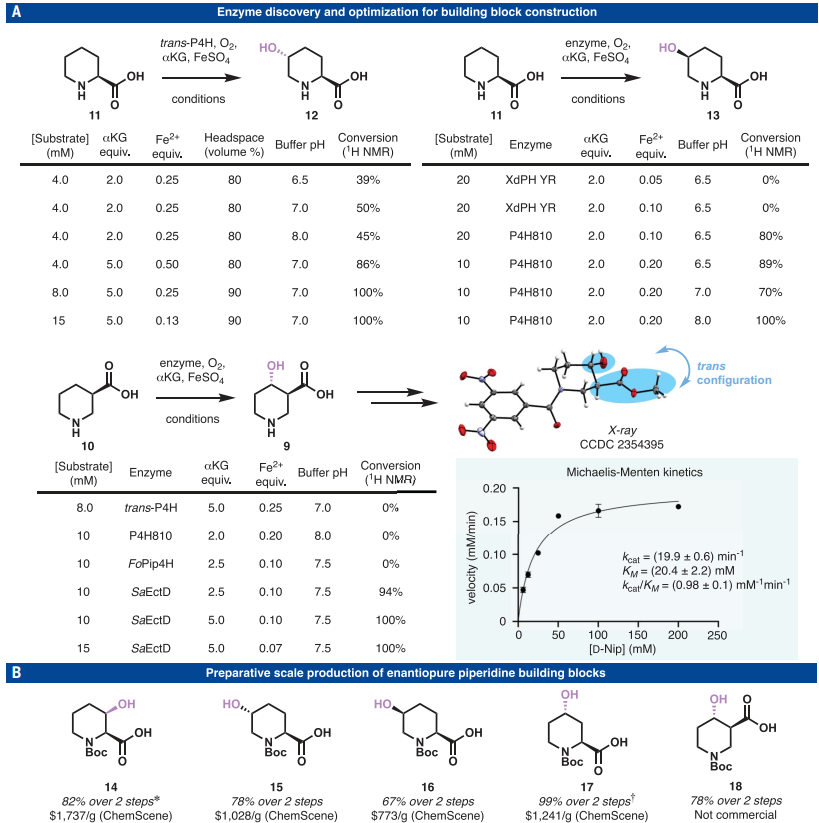
圖2. 規(guī)模化生物催化羥基化的開發(fā)
2,4-二取代哌啶是合成中的重要組成部分,也是許多生物活性分子的核心骨架。圖3B說明了如何通過生物催化獲得17可以大大減少獲得此類分子所需的工作量。從天然產物SS20846 A 4的改進方法中看出,以前的合成需要6到17 步,所有這些步驟都依賴于極性鍵斷開。通過使用基于自由基的Ni電催化脫羧烯基化17與乙烯基溴29直接以高dr(7:1,51%分離產率)獲得4,可以實現一種更簡單的方法,從而避免自燃試劑、手性助劑和非戰(zhàn)略性還原。
LNP023,也稱為Iptacopan,是諾華公司開發(fā)的一種經FDA批準的藥物,藥物化學家采用九步路線獲得關鍵中間體38,然后進行手性超臨界流體色譜分離和多次FG 和氧化還原操作。相比之下,17與碘芳烴30的Ni電催化交叉偶聯,然后進行乙基化,無需保護OH基團,即可在高dr下直接得到中間體32,隨后使用兩個已知步驟將32轉化為33。從藥物化學的角度來看,這是很有吸引力的,因為可以在合成結束時通過骨架鍵形成反應(C-O和C-C)直接檢測SAR。

圖3. 通過生物催化C-H氧化或自由基偶聯串聯實現哌啶酸的多樣化

圖4. 通過生物催化C-H氧化或自由基偶聯序列實現3-哌啶酸的多樣化
3,4-二取代哌啶是藥物化學中常見的片段,它們的合成通常需要費力的多步驟過程。如圖4所示,8是一種高活性的單胺轉運配體。在之前的合成中(圖4A),將格氏試劑添加到昂貴的不飽和哌啶6中,然后進行手性拆分和差向異構化,隨后需要進行酯還原、氧化、Horner-Wadsworth-Emmons反應和另一次酯還原,通過八步得到目標分子。相比之下,生物催化衍生的對映體純18可以與47進行雙重脫羧交叉偶聯(dDCC),以高dr (>20:1)得到中間體48。隨后,48可使用2-氯-3-乙基苯并[d]-噁唑-3-鎓鹽(CEBO)或四丁基溴化銨進行原位溴化,然后與49進行高度非對映選擇性的Ni-電催化偶聯。本文中,與使用化學還原劑相比,轉化率更高。同時進行Boc和酯還原,僅需五步即可從10得到目標產物,從而無需手性拆分、自燃試劑和多次氧化還原操作。
復雜手性3,4-二取代哌啶61是一種中間體,用于生產一種強效且選擇性的腎素抑制劑,具有進一步臨床開發(fā)的特性(圖4B)。雖然61 的合成工藝能以公斤級生產這種化合物,但總體路線完全依賴于極性鍵斷裂和哌啶亞基和芳基側鏈的貴金屬催化。本文中,二溴苯甲酸55可與環(huán)丙胺形成酰胺鍵,然后進行單選擇性Ni-Ag電催化脫羧芳基化以提供芳烴57,然后可通過BH3還原得到芐胺58。哌啶亞基的工藝規(guī)模路線從市售的芐基保護的β-酮酯62開始,共經過10步獲得目標分子,其中只有三個形成骨架鍵(C-C和C-N)。而本文中,可以通過18與芐胺58的酰胺偶聯和Appel反應生成烷基碘化物,然后在Ni-Ag電催化下與碘吡啶酮60偶聯,從而獲得相同的產物。在這個五步序列中,其中四個步驟是骨架鍵形成,貴金屬被完全去除。僅基于所用金屬的原始成本保守估計的成本節(jié)約是巨大的,相差三個數量級。
總結
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn